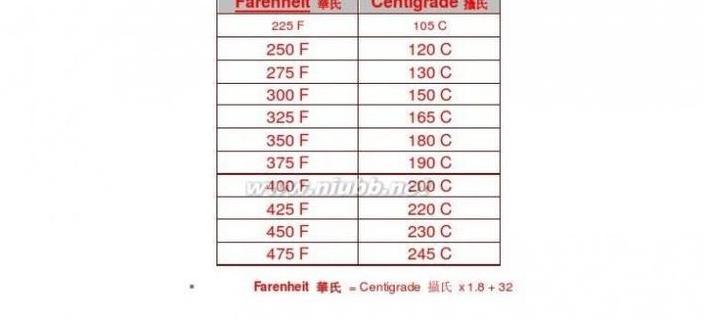
熵定律的计算公式
计算公式1 Clausius首先从宏观的角度提出了熵的概念。提出了熵的概念,该公式为:S =KlnΩ,这是微观状态的数量,通常被认为是描述混乱程度的数量。
3 鉴于当前的ω情况很难理解和使用,作者认为ω与理想气体系统的宏观参数成正比,也就是说:ω(t)=(t /εt)3 / 2 ,ω(v)= v /εv,理想气体的体积熵为sv =klnΩv= klnv,温度熵为st = klnΩt=(3 /2 )klnt,计算任何过程的熵差公式为△s =(3 /2 )kln(t'/ t) + kln(v'/ v),这种关系显微镜和大镜面公式熵公式易于理解且易于使用,并且有利于教学。
熵公式上方的三代人正式使用物理量,即“直观→摘要→Intuites”。
扩展数据熵定律是爱因斯坦的观点最好的科学定律。
我们知道能量,例如材料和信息,是材料世界的三个基本要素之一。
彼此,它是平衡的,没有生育或死亡。
熵的概念来自物理学,用于测量热力学系统中的疾病程度。
热力学的第二定律,也称为“熵定律”,表明在自然过程中,隔离系统的混乱总数(即“熵”)不会减少。
详细信息最高的法律是等电位计划。
非热能热能的效率小于1 00%。
,热流的方向取决于系统的电位焓(势能 +焓)的差异,即热量会自动导致从电位焓区引导到潜在焓的高区域。
低电位焓区具有高温,热量在高温下在高温下自动从该区域传播到低温,而无需支付其他费用,即减少“绝对熵的过程”。
显然,熵描述的能量转化法比节能法更为重要。
是“收银员”。
熵定律的计算公式
熵定律是科学最重要的法律,爱因斯坦认为它是科学的终极。它揭示了能源与物质世界中物质和信息的三个基本要素之间的密切联系,尤其是能源保护法,这是物理定律的最基本原则,表明总数在该法期间保持不变。
能量转换过程。
熵的概念来自热力学,用于测量系统中的混乱程度。
。
Clausius首先提出了熵的宏定义,通过热能的转换来定义熵,其计算公式为:S = Q / T(△Q)。
Boltzmann从显微镜的角度定义了熵,其公式为:S =KlnΩ,其中ω表示显微镜的数量,而S被认为是混乱程度的定量索引。
作者指出,微观状态的数量很难直观地理解并且令人尴尬地使用,因此他提出了一种旨在提高易于理解和使用的熵的新熵公式。
基于理想的气体模型,ω与宏观参数成正比,也就是说:ω(t)=(t /εt)3 /2 ,ω(v)= v /εv。
由此,我们推断出理想气体SV =KlnΩv= klnv的体积熵和温度熵ST =klnΩt=(3 /2 )klnt。
任何过程中熵差异的公式为△s =(3 /2 )kln(t'/ t) + kln(v'/ v),这不仅易于理解和使用,而且易于教学并学习。
熵定律不仅对物理领域产生了深远的影响,而且在许多领域(例如工程技术,化学反应和生物过程)中广泛使用,指导人类的理解和对自然的使用。
熵增加的原理揭示了等电位表面上能量转化的方向性。
在严重程度的领域,热量自动从升高到低势能区域的势能区域循环,这不仅影响能量利用的有效性,而且还会指导人类生产和生命的各个方面。
熵定律就像公司开发的“老板”,指导公司开发的方向,而能源保护定律就像公司的“收银员”一样,管理公司的财务状况。
熵定律的重要性在于,它揭示了能量转化的深度定律,这比节能定律更为重要,并指导人类如何更有效地使用能量。
环境的熵变,系统的熵变,和总熵变分别都怎么计算呀?请详细讲解,谢谢!
环境变化的计算公式由环境的热变化Q共享,环境温度也可以通过环境温度t的共享热变化 - 系统的共享热变化-Q进行计算。特别是,该区域的熵变化是相同的Q(环境)/t(环境)和相等的-Q(系统)/t(环境)。
系统的变化分为三种情况:简单的PVT变化,相变和化学变化。
在简单的PVT变化的情况下,理想气体的进入可以通过公式ΔS= NCV,MΔLNT2 /T1 +NRLNV1 /V2 恒定压力来计算。
如果相变的变化,则可以通过摩尔相变熵ΔS=NΔSM来计算可逆相变的减少,并且化学变化是通过摩尔反应零计算的。
熵的总体变化是环境变化和系统变化的总和。
如果反应物和产物都处于标准状态,则反应过程的变化是反应的标准生成。
如果反应反应进展的反应进展是对反应的标准变化反应反应的标准熵,该反应的反应变化为△rsm。
热力学的第三定律表明,纯物质的晶体是零度热力学的熵。
系统的熵仅与整个状态有关,与该过程无关。
因此,可以通过使用热温比的积分设计可逆过程来在不可逆的过程中计算熵变化。
绝热的自由扩展过程是一个不可逆转的过程。
过程是等温过程。
确定热力学过程是否可逆的是解决问题的关键。
如果是可逆的过程,则可以直接使用上述公式来解决问题。
解决熵的变化。
为了充分解决熵变化的问题,您必须掌握过程方程,迈耶公式,特定的热容量以及其他可逆过程中的其他常用表达式。
熵产和熵流的计算公式
法律的:不希望从低温的物体流出:s =∫DQ/t或ds = dq/t,其中s Entopy.q是热量。温度表示。
在特定过程中从系统中。
S =∫DQ1 /T1 +∫DQ2 /T2 假设DQ1 是为了增加高温量的温度。
T1 是其绝对温度,DQ2 是低温物体的热增加。
T2 是其绝对温度,然后DQ1 = -DQ2 总是往往总是孤立的系统,最终最终,最终是最终。
通过向环境发射热量,开放系统可能会减少熵,而现代科学的数量越大。
通信理论中的一个基本概念是,该系统包含一个特定的结构,这意味着它包含某些信息,这意味着减少熵或熵的负面信息。
相应的温度是协调的。
2 原理增加:它可以确定过程的方向。
作为Thermal Dynamica的第二定律的数学表达4 .4 熵的产生并实现功能能量1 以下形式创建一个熵方程:(熵 - 抗 - 肠道的入口 - 抗 - 肠) +抗-ant生产=系统变化或熵的产生=((((抗-anti)符号:undabstum为0。
该过程的特征和路径。