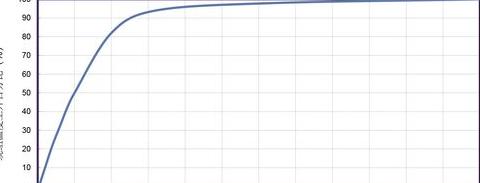
反应速率常数为什么会随着温度的升高而增大?
性质,分心,温度和礼服是与反馈有关的重要问题。气体的响应与压力有关。
增加申请人数量的申请人数量,增加了该单位中分子数量增加分子数量增加的分子数量。
未能升高温度是吸烟分子的百分比,并增加分子的数量,以提高观察时有效性。
正面目录的使用会改变响应过程,减少所需的刺激并加速响应量。
在化学产品中,通常控制计划情况以加速产品的响应。
应采取措施降低选举速度以延长产品的使用。
受访者可以描述为扩展Prome和申请人信息的公式:K(t)是永久的,可以随着温度改变温度。
准备活动的准备。
(当响应以一定级别发生时,可以指定单位(单位单位)(单位单位)) 可以经验。
化学反应以平均平均时间(在特定时间内)和快速时间(指定时间内)的平均水平进行。
为什么化学反应的速率常数与温度有关?
化学反应速度的常数与以下因素有关:1 浓度:试剂的浓度越大,试剂之间的碰撞频率越大,从而增加了反应速度的常数。相反,试剂的浓度越低,反应速度的常数越低。
2 随着温度的增加,反应速度的常数也会增加。
3 催化剂本身在反应过程中不会消耗,因此可以反复使用。
4 气体反应速度的常数较高,因为气体分子可以更容易碰撞。
液体反应速度的常数通常在两者之间。
5 压力对固体和液体反应的影响相对较小。
扩展信息:反应速度的常数是化学反应速度的重要参数,通常表示为K。
几个速度常数的值间隔很大,有些非常小,有些很大。
速度常数的数值大小决定了化学反应的速度。
速度常数越大,反应速度越快,反应越强烈,反应速度越强。
它描述了每次时间反应发生的速度,使试剂的浓度发生。
在化学动力学中,反应速度的常数是指随着试剂的浓度是在一定温度下的单一浓度时,反应的数量是随着统一的时间的数量。
对于简单的一般反应,反应速度的常数可以表示为k = ae^( - ea/rt),其中a是肛门的常数,ea是激活能,r是气体常数,t是反应温度。
从反应动力学角度考虑,增高反应温度使()
从反应动力学的角度来看,反应温度增加了反应速率常数()反应速率常数值(正确答案)不会改变反应速率常数,侧反应速度常数降低了侧反应速度恒定值(反应速率常数可降低正确的答案)。速率常数与什么有关
速率常数与反应温度和反应物浓度有关。解释如下:1 反应温度的影响速率常数反映了化学反应的速度,温度是影响反应速率的重要因素之一。
根据Alenius方程,化学反应速率和温度速率之间的关系是指数的。
当温度升高时,分子运动速度会增加,从而导致反应物分子之间的碰撞频率增加,从而提高了反应速率。
因此,速率常数随温度升高而增加。
2 反应物浓度的影响反应物的浓度也是影响速率常数的重要因素之一。
当反应物浓度增加时,单位体积中的分子数增加,这增加了反应物分子之间有效碰撞的可能性,从而增加了反应速率。
因此,在一定范围内,随着反应物浓度的增加,速率常数也将相应增加。
3 除温度和浓度外,其他影响因素还可能与诸如反应物的性质,催化剂的存在和压力等因素有关。
不同的反应可能具有不同的速率恒定影响因素,这些因素需要在特定的化学反应条件下进行分析和判断。
简而言之,速率常数主要受反应温度和反应物浓度的影响。
理解和掌握这些因素对于预测和控制化学反应速率具有重要意义。